Ministry of Health: The key to progress is to support the scientific elite/ The average speed of scientific growth is 7.44, but in medical sciences it is 8.23
۱۹ اردیبهشت، ۱۴۰۲با وجود پیشرفت در ژنتیک انسانی، افرادی که از اختلالات نادری مانند دیستروفی عضلانی دوشن (DMD) رنج می برند، همچنان با طیف محدودی از گزینه های درمانی و کوتاه شدن طول عمر مواجه هستند.
فناوری CRISPR-Cas9 دانشمندان را قادر می سازد تا نواحی ژنومی خاص را به طور دقیق مورد هدف قرار دهند و تغییرات دقیقی را در جهش های بیماری زا در سلول های انسانی ایجاد کنند.
برای اهداف بالینی، تحویل موثر و مستقیم اجزای عملکردی CRISPR – نوکلئاز Cas9 و RNA تک راهنما (sgRNA) – به بدن بیمار ضروری است.
تحقیقات روی موش ها نشان داده است که ویروس های مرتبط با آدنو می توانند CRISPR-Cas9 را با موفقیت تحویل دهند.
با این حال، این نگرانی وجود دارد که بیان طولانی مدت از وکتورهای DNA CRISPR-Cas9 ممکن است منجر به اثرات نامطلوب شود، مانند برش غیر اختصاصی ژنهای مهم درگیر در عملکرد سلولی یا جهشهای ناخواسته در انکوژنها که به طور بالقوه میتواند منجر به تشکیل تومور شود.
علاوه بر این، اثربخشی AAV برای تحویل ممکن است به دلیل پاسخ های ایمونولوژیک کاهش یابد. برای اینکه بیماران بتوانند از مزایای کامل پیشرفتهای اخیر ژنومیک بهره ببرند، پزشکان به یک سیستم تحویل جایگزین نیاز دارند که بتواند اجزای CRISPR-Cas9 را به طور موقت منتقل کند.
این سیستم به CRISPR-Cas9 اجازه می دهد تا یک توالی DNA خاص را هدف قرار دهد، تغییرات درمانی لازم را انجام دهد و سپس به سرعت تخریب شود تا احتمال هرگونه پیامد منفی را به حداقل برساند.
بنیاد و پایه
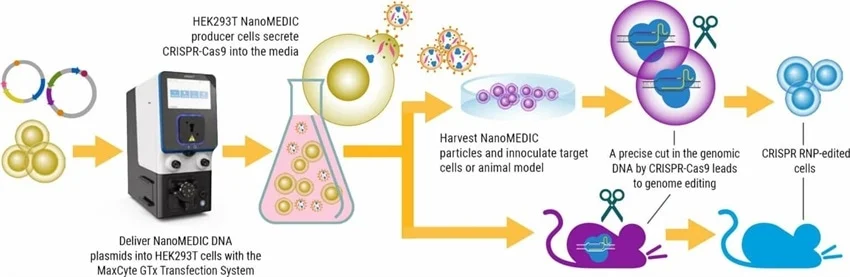
یک مطالعه اخیر در Nature Communications یک سیستم تحویل موقت جدید به نام NanoMEDIC را معرفی می کند. این نانوسیکل خارج سلولی مهندسی شده حاوی یک کمپلکس ریبونوکلئوپروتئین CRISPR-Cas9 (RNP) است.
CRISPR-Cas9 RNP پس از حذف RNA ژنومی ویروسی و مهندسی اجزای لنتی ویروسی ساختاری، با استفاده از مکانیزم دیمریزاسیون ناشی از لیگاند شیمیایی بسته بندی می شود. این امکان حفظ خواص تحویل لنتی ویروس را بدون خطرات طولانی مدت مرتبط با ادغام ناقل ویروسی فراهم می سازد.
علیرغم امکانسنجی تولید NanoMEDIC در مقیاس کوچک برای تحقیقات پایه، هدف محققان توسعه یک رویکرد مقیاسپذیر برای تولید آن با استفاده از سیستم Flow Electroporation® سازگار با cGMP بود که میتوان از آن برای اهداف تولید صنعتی استفاده کرد.
نتیجه
یافته های این مطالعه پتانسیل یک سیستم تحویل گذرا CRISPR-Cas9 را نه تنها برای ژن درمانی بلکه برای تحویل محموله های دیگر از جمله آنتی ژن های ویروسی نشان می دهد. این فناوری ممکن است پیامدهایی برای توسعه واکسن داشته باشد، زیرا می تواند برای ایجاد یک پاسخ ایمنی درمانی مورد استفاده قرار گیرد.
فرآیند تولید توسعه یافته در این مطالعه فاقد اجزای حیوانی است. از MaxCyte Flow Electroporation® برای تسهیل تولید مقیاس پذیر سلول های NanoMEDIC با پتانسیل تولید میلیاردها سلول استفاده می کند.